کشف یکی از ذرات کوچک تر از اتم
دانلود گزارش کار شیمی فزیک سری یک
نمونه گزارش کار محاسبات (دانشگاه شهرری)Adiabatic
کنکاشی در ماهیت \ ماده ، فضا و زمان \
در نظریه سی. پی. اچ. همه ی ذرات از سی. پی. اچ. تشکیل می شود
زمان زیر شنل فیزیکدانان 110 نانوثانیه نامرئی شد
شیم فزیکی مبانی ترمودینامیک شیمیایی و نظریه ملکولی
آزمایش تامسون ( محاسبه نسبت بار به جرم الکترون )
گزارش کار شیمی معدنی2 شیمی عمومی2
برگه اطلاعات ایمنی مواد شیمیایی دانلود کنید.
دو مقاله در مورد خطرات جیوه و ترکیبات آن
آمینها و سایر ترکیبات حاوی نیتروژن از جمله فراوانترین مولکولهای آلی هستند. همه آمینها خصلت بازی دارند (آمینهای نوع اول و دوم میتوانند به عنوان اسید هم عمل کنند) ، پیوند هیدروژنی تشکیل میدهند، و در واکنشهای جانشینی به عنوان هسته دوست عمل کنند. پس در بسیاری از جنبهها شیمی آمینها با شیمی الکلها و اترها شباهت دارد. ولی تفاوتهایی هم در فعالیت دارند، زیرا الکترونگاتیوتیه نیتروژن کمتر از اکسیژن است.
بسیاری از ترکیبات فعال بیولوژیکی حاوی نیتروژن هستند. بسیاری از آمینهای ساده به عنوان دارو مصرف میشوند. علاوه بر کاربرد آمینها در داروسازی و تفکیک انانیتومرها ، آمینها موارد استفاده گوناگونی در صنعت دارند. هگزا متیلن دی آمین (HMDA) یک آمین ، با اهمیت تجاری است. که ماده اولیه تهیه صنعتی نایلون است. این ماده با هگزان دی اوییک (آدپیک) اسید ، کوپلیمر میشود و نایلون 6 ، 6 ایجاد میگردد. از این نایلون جوراب ، جامههای کشباف و میلیونها تن الیاف نساجی ساخته میشود.
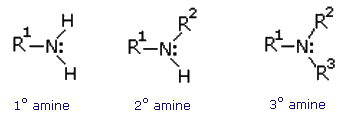
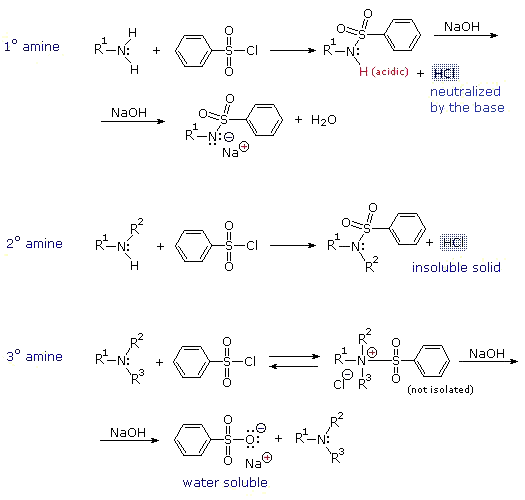
برای شناسایی آمینها از تست های زیر استفاده می شود ، علاوه بر این انحلال پذیری و ویژگی بازی آمینها یکی از بهترین راههای شناسایی آنها ست. ( می توانید به بخش حلالیت مراجعه کنید).
1- آزمایش هینزبرگ
1/0 میلی لیتر از آمین مایع یا 1/0 گرم از آمین جامد و 2/0 گرم پارا – تولوئن سولفونیل کلرید و 5 میلی لیتر محلول سدیم هیدروکسید 10 % را در یک لوله آزمایش کوچک بریزید. درب لوله را کاملاً ببندید و برای 3-5 دقیقه آنرا تکان دهید. سپس درب لوله را بردارید و در حالیکه آنرا تکان می دهید برای یک دقیقه بوسیله حمام بخار حرارت دهید. بعد لوله را بگذارید سرد شود و یک قطره از آنرا روی کاغذ PH قرار دهید چنانچه PH آن بازی نیست، مقدار بیشتری سدیم هیدروکسید اضافه نمایید تا به PH بازی برسد. چنانچه رسوب تشکیل شود، مخلوط بازی را با افزایش 5 میلی لیتر آب رقیق نمایید و خوب تکان دهید. اگر رسوب نامحلول باشد، ممکن است سولفون آمید دو استخلافی تشکیل شده باشد که در اینصورت آمین نوع دوم است. ( توجه : رسوب نامحلول ممکن است پارا – تولوئن سولفونیل کلرید شد که در واکنش شرکت نکرده است ). اگر بعد از رقیق کردن مخلوط رسوبی باقی نماند، یا اگر از ابتدا تشکیل نشده بود، به دقت به محلول هیدروکلریک اسید 5 % اضافه نمایید و با کاغذ لیتموس PH آن را برای اسیدی بودن بررسی کنید. اگر در این مرحله رسوب ایجاد شد، دلیل بر تشکیل سولفون آمید یک استخلافی است یعنی مجهول، آمین نوع اول است. اگر هیچگونه واکنشی انجام نشد، مجهول ممکن است آمین نوع سوم باشد.
چنانچه نتایج حاصل از روش بالا واضح نبود می توانید به جای پارا – تولوئن سولفونیل از 2/0 میلی لیتر بنزن سولفونیل کلرید استفاده کنید. در صورت استفاده از این واکنشگر محصول جامد تشکیل نمی شود و محصول بصورت روغنی است.
حلالیت
عوامل موثر در حلالیت
معمولا ترکیبات قطبی در حلالهای قطبی و ترکیبات غیر قطبی در حلالهای غیر قطبی حل میشوند.
در ترکیبات مشابه افزایش نیروی بین مولکولی سبب کاهش حلالیت میگردد.
در ترکیبات مشابه افزایش وزن مولکولی سبب کاهش حلالیت میشود.
در ترکیبات مشابه وجود شاخه جانبی باعث افزایش حلالیت میگردد.
استفاده از حلالیت در شناسایی جسم ناشناخته
استفاده از حلالیت تا اندازه ای عوامل شیمیایی موجود در جسم آلی را مشخص میکند. مثلا ترکیبات اسیدی معمولا در سود و ترکیبات قلیایی معمولا در اسید کلریدریک 5% حل میشوند.
استفاده از حلالیت اطلاعاتی در مورد بعضی از خصوصیات ترکیب ناشناخته میدهد. از حل شدن یک جسم در آب تا اندازه ای به قطبی بودن آن مطمئن میشویم و یا در حالیکه اسید بنزوئیک در آب حل نمیشود اما در صورتیکه با سود ترکیب شود تولید بنزوات سدیم میکند که براحتی در آب محلول است.
استفاده از حلالیت اطلاعاتی را در مورد وزن مولکولی جسم ناشناخته میدهد، مثلا در مورد سریهای همانند (همولوگ) که دارای یک عامل شیمیایی باشند معمولا آنهایی که تعداد کربن آنها کمتر از 4 باشد در آب حل و آنهایی که تعداد کربن آنها بیش از 5 اتم کربن باشد معمولا در آب نامحلولند.
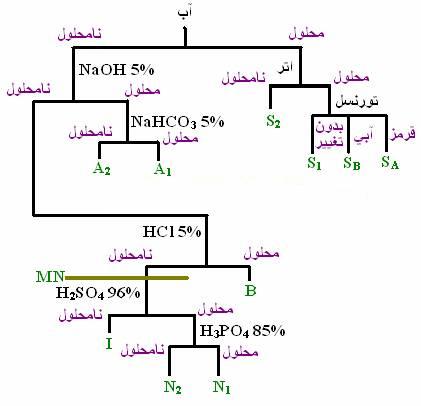
طبقه بندی بر اساس حلالیت
آزمون حلالیت برای هر جسم مجهولی باید انجام شود. این آزمون در تشخیص گروههای عاملی اصلی ترکیبات مجهول دارای اهمیت است. حلالهای متداول برای آزمایش حلالیت عبارتند از:
HCl 5%, NaHCO3 5%, NaOH 5%, H2SO4, Water, Organic Solvent
ترکیبات با توجه به حلالیتشان به 7 گروه تقسیم میشوند:
گروه 1) ترکیباتی که هم در آب و هم در اتر محلولند
گروه 2) ترکیبات محلول در آب و نامحلول در اتر
گروه 3) نامحلول در آب ولی محلول در محلول رقیق سدیم هیدروکسید که به دو دسته زیر تقسیم میشوند:
الف) محلول در سدیم هیدروکسید رقیق و محلول در سدیم بیکربنات 5%
ب) محلول در سدیم هیدروکسید رقیق و محلول در کلریدریک اسید رقیق
گروه 4) نامحلول در آب ولی محلول در هیدروکلریدریک اسید رقیق
گروه 5) هیدروکربنهایی که شامل کربن، هیدروژن و اکسیژن هستند ولی در گروه 1 تا 4 نبوده ولی در سولفوریک اسید غلیظ محلولند
گروه 6) تمام ترکیباتی که ازت یا گوگرد ندارند و در سولفوریک اسید غلیظ نامحلولند
گروه 7) ترکیباتی که ازت یا گوگرد داشته و در گروه 1 تا 4 نیستند. تعدادی از ترکیبات این گروه در سولفوریک اسید غلیظ محلولند.
دسته بندی ترکیبات بر اساس حلالیت را میتوان به صورت زیر نشان داد. هر یک از گروههایی که با حرف لاتین مشخص شده اند بعنوان گروه حلالیت دسته ای خاص از ترکیبات شناخته میشوند.
SA
اسیدهای کربوکسیلیک تک عاملی کمتر از 6 کربن و سولفونیک اسیدهای آروماتیک
SB
آمینهای تک عاملی کمتر از 7 کربن
S1
الکلهای تک عاملی، آلدئیدها، کتونها، اترها، نیتریلها و آمیدها ی کمتر از 6 کربن
S2
نمک اسیدهای آلی، آمین هیدروکلراید، آمینو اسیدها، کربوهیدراتها، پلی هیدروکسیها، اسیدهای چند عاملی
A1
اسیدهای آلی قوی، کربوکسیلیک اسیدهای دارای بیش از 6 کربن، فنولها با استخلافهای الکترون گیرنده ارتو و پارا، بتا دی کتونها
A2
اسیدهای آلی ضعیف، فنولها، انولها، ایمینها، ایمیدها، سولفونامیدها، تیوفنولها کمتر از 5 کربن، بتا دی کتونها
B
آمینهای آلیفاتیک بیش از 7 کربن، آنیلینها (فقط یک گروه فنیل)، بعضی اکسی اترها
MN
ترکیبات خنثی متفرقه دارای نیتروژن یا گوگرد کمتر از 5 کربن
N1
الکلهای کمتر از 9 کربن، آلدئیدها، متیل کتونها، کتونهای حلقوی، استرهای تک عاملی بیشتر از 5 کربن، اترهای کمتر از 8 کربن، اپوکسیدها
N2
آلکنها، آلکینها، اترها، بعضی ترکیبات آروماتیک دارای عوامل فعال، کتونهای غیر از گروه بالا
I
هیدروکربنهای اشباع، هالوآلکانها، آریل هالیدها، دی آریل اترها، آروماتیکها با گروههای غیر فعال
بخش عملی
حلالیت در آب
یک دهم گرم جسم جامد کاملا پودر شده و یا 2 قطره نمونه مایع را در لوله آزمایش ریخته و 3 سی سی آب مقطر بر روی آن بریزید و با ضربه انگشت آن را مخلوط کنید. پس از مدتی چنانچه اثری از نمونه مایع یا جامد دیده نشد انحلال صورت گرفته است. هنگامی که هوای آزمایشگاه سرد است چند لحظه گرم کردن محلول روی شعله ملایم، مفید است.
حلالیت در اتر
مطابق حلالیت در آب، با حلال اتر در یک لوله آزمایش کاملا خشک، آزمون را انجام دهید. مشاهده خط مرزی بین دو مایع معمولا مشکل است بنابر این با تکان دادن، چنانچه محلول کدر شد انحلال صورت نگرفته است. ترکیبات غیر یونیزه و آنهاییکه یک گروه عاملی دارند معمولا در اتر حل میشوند.
حلالیت در سود 5%
به افزایش احتمالی درجه حرارت توجه کنید. اگر ترکیب نا محلول به نظر میرسد، کمی از قشر مایع رویی را بوسیله قطره چکان برداشته و به یک لوله کوچک انتقال دهید. محلول کلریدریک اسید 5% را قطره قطره به آن اضافه کنید تا محلول اسیدی شود. اگر رسوب تشکیل شد، در گروه سوم قرار میگیرد. هرگز حرارت به کار نبرید چون ممکن است باعث هیدرولیز شود.
حلالیت در سدیم بیکربنات 5%
اگر ترکیب مورد نظر در سود 5% محلول بود، حلالیت آنرا در بیکربنات 5% امتحان کنید. مخصوصا به خروج گاز دی اکسید کربن توجه کنید. کربوکسیلیک اسیدها، سولفونیک اسیدها و فنلهای استخلافی در این گروه هستند.
حلالیت در سدیم کلریدریک اسید 5%
بعضی از بازهای آلی مثل نفتیل آمین، کلر هیدرات محلول در آب میدهند ولی در زیادی اسید رسوب میکنند. اگر محلول بود در گروه چهارم است. اگر به نظر غیر محلول است کمی از قسمت فوقانی مایع را با قطره چکان به لوله دیگری انتقال داده و محلول سود 5% اضافه کنید تا قلیایی شود. تشکیل رسوب مجهول را در گروه چهارم قرار میدهد. حرارت بکار نبرید
حلالیت در سدیم سولفوریک اسید غلیظ
این آزمون را در لوله آزمایش خشک انجام دهید. آیا تغییر رنگی مشاهده میشود؟ به ایجاد ذغال، خروج گاز، پلیمریزه شدن و یا ایجاد رسوب توجه کنید.
حلالیت در سدیم فسفریک اسید 85%
پدیده هایی مثل ایجاد رنگ و یا گرم شدن در این مورد وجود ندارد.
سولات آخر فصلهای 1 تا 8 کتاب شیمی فزیک مبانی ترمودینامیک شیمیایی و نظریه جنبشی
(استاد نظری )
دانشگاه شهرری
رو برای دانلود
دانلود سولات به تفکیک فصل
محلول سازی :
محلول سازی یکی از متداولترین و در عین حال دقیق ترین کارهایی است که در آزمایشگاه انجام میشود. محلول سازی به معنای ساختن محلول مورد نظر و لازم از محلولهای استاندارد میباشد.
محلولی را استاندارد می گویند که در آن ، رابطه بین مقادیر ماده حلشده و محلول یا رابطه بین مقدار ماده حلشده و حلال بنحوی معلوم باشد. با معلوم بودن مقدار ماده حلشونده و مقدار حلال تشکیل دهنده محلول ، غلظت محلول مشخص میگردد. بسیاری از واکنشها در حالت محلول انجام میشوند و محاسبههای کمی برای اینگونه واکنشها بر مبنای غلظت آنها صورت میگیرد. برای بیان غلظت ، روشهای گوناگونی وجود دارد و محلولهای استاندارد را براساس غلظت بیان میکند.
محلولهای استاندارد کاربردهای زیادی دارند، از جمله در تجزیه های تیترسنجی (تیتراسیون) ، واکنشهای خنثی شدن و واکنشهای اکسیداسیون-احیا و...
برای محلول سازی باید ابتدا با واحدها و روش های بیان غلظت یک محلول، آشنایی کامل داشته باشید:
محلول درصد جرمی :
فسرسانس و فلوئورسانس پدیده هایی هستند که در آنها یک ماده خاص که بطور عام به آن فسفر گفته میشود پس از قرار گرفتن در مقابل نور مرئی یا غیر مرئی یا حرارت ( تحریک شده ) این انرژی را در خود ذخیره می کند و سپس آن انرژی را بصورت طیفی از امواج مرئی در طول مدت زمانی منتشر می کند .
. اگر این بعنوان شباهت این دو پدیده باشد تفاوت آنها در اختلاف زمانی بین این دو دریافت و تابش یا به عبارت گر دوام تابش است . اگر زمان تحریک کمتر از 10 به توان 8- ثانیه باشد، این پدیده را Fluorescent می نامیم و اگر زمان تحریک بیش از 10 به توان 8- ثانیه باشد آن را Phosphorescent می نامیم.به عبارتی در فسفرسنس تحریک طولانی تر و تشعشع طولانی تری داریم و در فلوئورسنس تحریک کوتاهتر تر و تشعشع کوتاهتری تری داریم.در فلوئورسانس که نمونه آن نور مهتابی یا صفحه تلویزیون است تابش آنی است و تقریبا" بلافاصله بعد از قطع نور تمام میشود . در حالی که در فسفرسانس ماده بعد از قطع نور نیز تا مدتی به تابش ادامه میدهد که مقدار آن بسته به ماده مورد استفاده می تواند از چند ثانیه تا چندین روز طول بکشد . در فلوئورسانس برانگیختگی میان دو تراز اصلی با انرژی های E1,E2 اتفاق می افتد که جابجایی بین أنها کاملا" أزاد است .الکترون با دریافت انرژی بر انگیخته شده وبه تراز E2 می رود وپس از 8تا 10 ثانیه دوباره به تراز اول بر می گردد و فتونی با انرژی E2-E1 تابش می کند اما در فسفرسانس ماجرابدلیل وجود یک تراز میانی کمی پیچیده تر است این تراز که مابین تراز پایه و برانگیخته قرار دارد تراز نیمه پایدار می باشد و مانند یک دام برای الکترونها عمل میکند به خاطر شرایط خاص این تراز انتقال الکترون از أن به سایر ترازها ممنوع واحتمال أن بسیار کم است بنابراین چنانچه الکترونی پس از برانگیختگی از تراز E2 در دام تراز نیمه پایدار بیافتد انجا می ماند تا زمانی که به طریقی دیگر مجددا" برانگیخته شود وبه تراز E2 برگردداین اتفاق می تواند تحت تاثیر جنبشهای گرمایی اتمها یا مولکولهای مجاور ویا برانگیختگی نوری روی دهد اما احتمال وقوع أن بسیار کم است به همین دلیل چنین الکترونهایی تا مدتها در تراز میانی می مانند (بسته به ساختار اتمی ماده و شرایط محیطی) وهمین عامل تاخیر در باز تابش بخشی از انرژی دریافت شده است.تحریک این ماده ها به گونه های مختلف انجام می شوند: بمباران فوتونی، الکترونها، یونهای مثبت، واکنشهای شیمیایی، گرما و گاهی اوقات ( مخصوصاً در جانداران ) تنش های مکانیکی... راز کرمهای شب تاب در فسفرسانس است.
برای ساختن مواد درخشنده در تاریکی باید فسفری وجود داشته باشد که با استفاده از نور معمولی انرژی بگیرد و طول تابش ان زیاد باشد.برای مثال دو فسفری که این ویژگی ها را دارند مثل ( Zinc Sulfide ) و ( Strontium Aluminate ). که ( Strontium Aluminate ) بهتر است برای طول تابش بیشتر.
این مواد با پلاستیک مخلوط میکنند و مواد درخشنده در تاریکی را میسازند.
بعضی مواقع ممکن است شما موادی را ببینید که میدرخشند ولی به انرژی احتیاجی ندارند!یکی از ان مثالها بروی عقربه های ساعتهای گران قیمت است.درانها فسفر با یک عنصر رادیو اکتیو مخلوط شده (مثل رادیوم- radium) که ان عنصر با انتشار رادیو اکتیو فسفر را مرتبا با انرژی میکند.
شرحی از نحوه ی کار لامپ های فلوئورسنت :
در این لامپها یک تخلیه ی الکتریکی در محیطی از بخار جیوه و یک گاز خنثی ( مانند آرگون ) انجام می شود. بخار جیوه بر اثر این تخلیه ی انرژی و جذب این انرژی، شروع به تشعشع می کند و طول موج این تشعشع 2537 آنگستروم است که در محدوده ی طیف UV ( فرا بنفش ) است.
از دیگر سوی، دبواره ی داخلی لامپ را با مواد فسفرسنتی پوشش می دهند و این مواد توسط اشعه ی UV تحریک شده، نور مرئی تابش می کنند.
در دهه ی 1940 این پوشش Zn2SiO4 (سیلیکات زیرکونیم) بود و از Mn بعنوان Activator استفاده می کردند. بعدها یک محلول فسفاتی به صورت Ca5.(PO4)3.(Cl,F).Sb3+ion.Mn2+ion - که Sb3+ion یعنی یون 3 بار مثبت آنتیموان - استفاده شد که Activator ان، Sb ( آنتیموان ) بود.
چه موادی این گونه هستند (نام عنصر ها) و رنگ نور انها به چه بستگی دارد؟
شماره - ماده ی زمینه - Activator - رنگ تشعشع - کاربرد
-------------------------------------------------------------- ( زمان عملکرد کوتاه )
1 - CaWO4 - بدون Activator - آبی - لامپ آبی
2 - Pb - CaWO4 - آبی کم رنگ - لامپ آبی
3 - Pb - BaSi2O5 - فرا بنفش - لامپ تشعشع طولانی مدت فرابنفش
4 - Mn - Zn2SiO4 - سبز - لامپ سبز
5 - Pb3Mn - CaSiO3 - بین زرد و نارنجی - لامپ رنگی با کیفیت بالا
6 - Mn - Cd2B2O5 - نارنجی / زرد - لامپ ترنر
-------------------------------------------------------------- ( زمان عملکرد طولانی )
1 - Mn - Zn2SiO4 - زرد سبز - رادار و اسیلوگراف
2 - Pb3Mn - CaSiO3 - نارنجی - رادار
3 - Mn - (Zn,Be).SiO4 - سفید - تلویزیون های دقیق
اینم متنی برای شیمی دوم دبیرستان
با تشکر
منتظر نظرات شما هستم
با سلام و عرض خسته نباشید خدمت دوستان گرامی
یکی از دوستان سوالی را مطرح کردند که برای جواب به این دوست عزیز پست حاضر تقدیم شما گرامیان می شود:
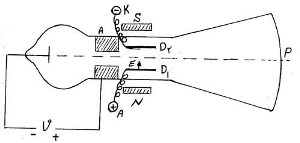
آزمایش تامسون ( محاسبه نسبت بار به جرم الکترون )
در آزمایش تامسون از اثر میدان الکتریکی و میدان مغناطیسی استفاده شده است. دستگاهی که در این آزمایش مورد استفاده قرار گرفته است از قسمتهای زیر تشکیل شده است:
الف ) اطاق یونش که در حقیقت چشمه تهیه الکترون با سرعت معین می باشد بین کاتد و آند قرار گرفته است. در این قسمت در اثر تخلیه الکتریکی درون گاز ذرات کاتدی ( الکترون ) بوجود آمده بطرف قطب مثبت حرکت می کنند و با سرعت معینی از منفذی که روی آند تعبیه شده گذشته وارد قسمت دوم می شود. اگر بار الکتریکی q تحت تاثیر یک میدان الکتریکی بشدت E قرار گیرد، نیروییکه از طرف میدان بر این بار الکتریکی وارد می شود برابر است با:
F= q.E
در آزمایش تامسون چون ذرات الکترون می باشند q = -e بنابراین:
F= -eE
از طرف دیگر چون شدت میدان E در جهت پتانسیلهای نزولی یعنی از قطب مثبت بطرف قطب منفی است بنابراین جهت نیرویF در خلاف جهت یعنی از قطب منفی بطرف قطب مثبت می باشد. اگرx فاصله بین آند و کاتد باشد کار نیروی F در این فاصله برابر است با تغییرات انرژی جنبشی ذرات . از آنجاییکه کار انجام شده در این فاصله برابراست با مقدار بار ذره در اختلاف پتانسیل موجود بین کاتد وآند بنابراین خواهیم داشت
ev0 =½m0v2
که در آن v0 اختلاف پتانسیل بین کاتد و آند e بار الکترون v سرعت الکترون و m0 جرم آن می باشد. بدیهی است اگر v0 زیاد نباشد یعنی تا حدود هزار ولت رابطه فوق صدق می کند یعنی سرعت الکترون مقداری خواهد بود که می توان از تغییرات جرم آن صرفنظ نمود . بنابراین سرعت الکترون در لحظه عبور از آند بسمت قسمت دوم دستگاه برابر است با:
v = ?(2e v0/ m0)
ب) قسمت دوم دستگاه که پرتو الکترونی با سرعت v وارد آن می شود شامل قسمتهای زیر است :
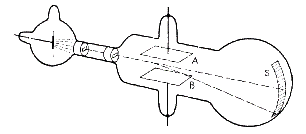
1- یک خازن مسطح که از دو جوشن A وB تشکیل شده است اختلاف پتانسیل بین دو جوشن حدود دویست تا سیصد ولت می باشد اگر پتانسیل بین دو جوشن را به v1 و فاصله دو جوشن را به d نمایش دهیم شدت میدان الکتریکی درون این خازن E = v1/d خواهد بود که در جهت پتانسیلهای نزولی است.
2- یک آهنربا که در دو طرف حباب شیشه ای قرار گرفته و در داخل دو جوشن خازن: یک میدان مغناطیسی با شدت B ایجاد می نماید . آهنربا را طوری قرار دهید که میدان مغناطیسی حاصل بر امتداد ox امتداد سرعت - و امتداد oy امتداد میدان الکتریکی - عمود باشد.